搜索


不受控的快速增殖是癌細胞區別於正常細胞的關鍵特征🧘🏿♀️。在癌細胞中🔻,以大分子合成及細胞分裂為目的的能量代謝通路被異常激活,而與增殖無關的代謝通路則受到抑製🖐🏼🛌。從恢復癌細胞正常代謝的角度出發,研究者們發現了腫瘤治療的重要靶點👨🏿🚀。但迄今為止,絕大多數靶向代謝的藥物和療法均聚焦於抑製過度激活的代謝通路,而多種代謝通路之間的代償效應嚴重阻礙了該思路的臨床療效。
近日🐨,沐鸣2平台材料科學系/聚合物分子工程國家重點實驗室步文博教授團隊顛覆性提出基於營養素納米化技術的代謝重激活新策略用於腫瘤治療。在研究中🔨🧑🏼🦲,團隊以黑色素瘤為例😗,通過納米營養素激活癌細胞被抑製的代謝通路,發現該策略擁有令人振奮的抗癌效果,該研究不但有助於臨床的聯合治療,還為腫瘤治療提供了全新範式。6月11日,相關成果以《基於營養素的黑色素瘤代謝重激活療法》(“Nutrient-delivery and metabolism reactivation therapy for melanoma”)為題發表於《自然-納米技術》(Nature Nanotechnology)。

在研究中,團隊首先提出如何針對不同腫瘤選擇受抑製的代謝通路進行激活。在此🤹🏻♂️,他們發現腫瘤細胞中大多數受抑製的代謝通路,是腫瘤起源組織-細胞類型特異性代謝。例如👩👩👧👧,皮膚黑色素瘤(SKCM)起源於黑色素細胞,合成及分泌黑色素是其重要的功能。而在晚期及轉移性SKCM患者中,黑色素合成代謝通路顯著下調(圖1a)📚👳🏻♀️,並且與患者生存期呈負相關(圖1b)。
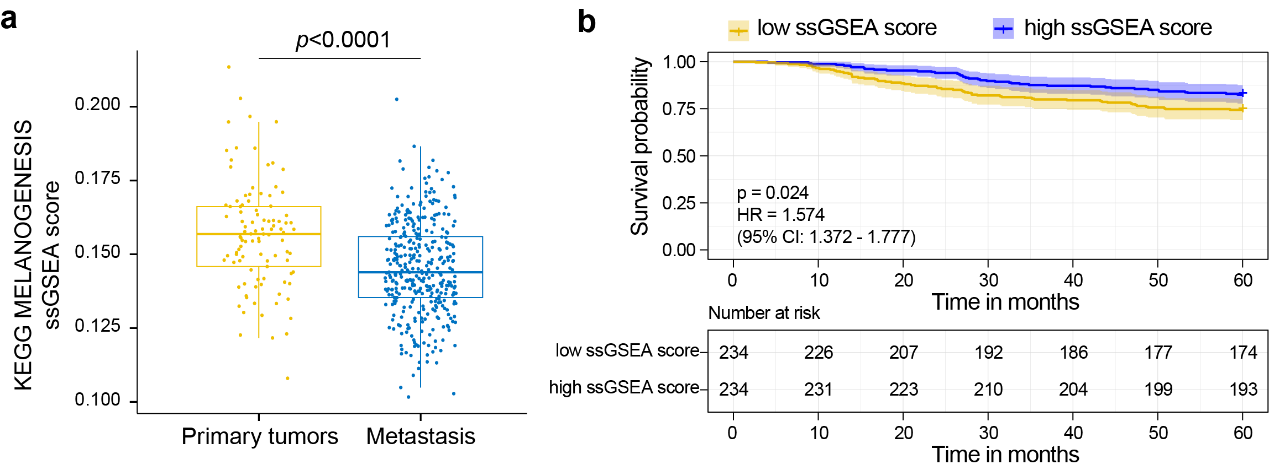
圖1. 黑色素合成代謝在SKCM 原發性和轉移性患者基因組富集分析中的得分(a)以及黑色素合成代謝與SKCM患者5 年生存率的關系(b)。
而能否高效、特異性激活目標代謝通路🌥,是代謝重激活策略成敗與否的關鍵🫄🏼。在該研究中💆🏽🤽🏽,研究人員並未大規模篩選酶激活劑,而是巧妙地將目光投向機體所需的營養物質👳🏻🙅🏼,如氨基酸🤽🏻♀️👋🏿、糖類、維生素等,因其可作為天然底物激活特定的代謝通路🧁。如酪氨酸作為黑色素合成的底物,可刺激黑色素合成🏌🏻。更值得一提的是🧑🏼🏫,營養物質安全、易得,且患者依從性好。然而,小分子營養物質在體內的生物利用度十分有限👯🕵🏻♀️,采用常規手段無法在癌細胞內補充具有治療劑量的營養物質實現對特定通路的高效激活。
為了解決這一技術瓶頸,在這項最新研究中🌾🚣🏿♀️,研究人員創新性提出營養物質納米化的新技術,僅僅利用機體中已有的營養小分子構建納米營養素,利用其與細胞膜的親和性及癌細胞對納米材料的胞吞作用,克服了癌細胞通過膜轉運受體對攝取營養物質的限製,在短時間內數倍提升特定營養物質的含量,從而顯著激活癌細胞被抑製的代謝通路👨🏻🦯。
如圖2所示,通過構建不飽和脂肪酸-酪氨酸-甘露糖三嵌段兩親分子😅,將酪氨酸製備成靶向黑色素瘤的可降解兩親納米膠束,可在12小時內顯著提升胞內酪氨酸的含量約8倍(補充遊離酪氨酸提高僅3倍左右)🔙。
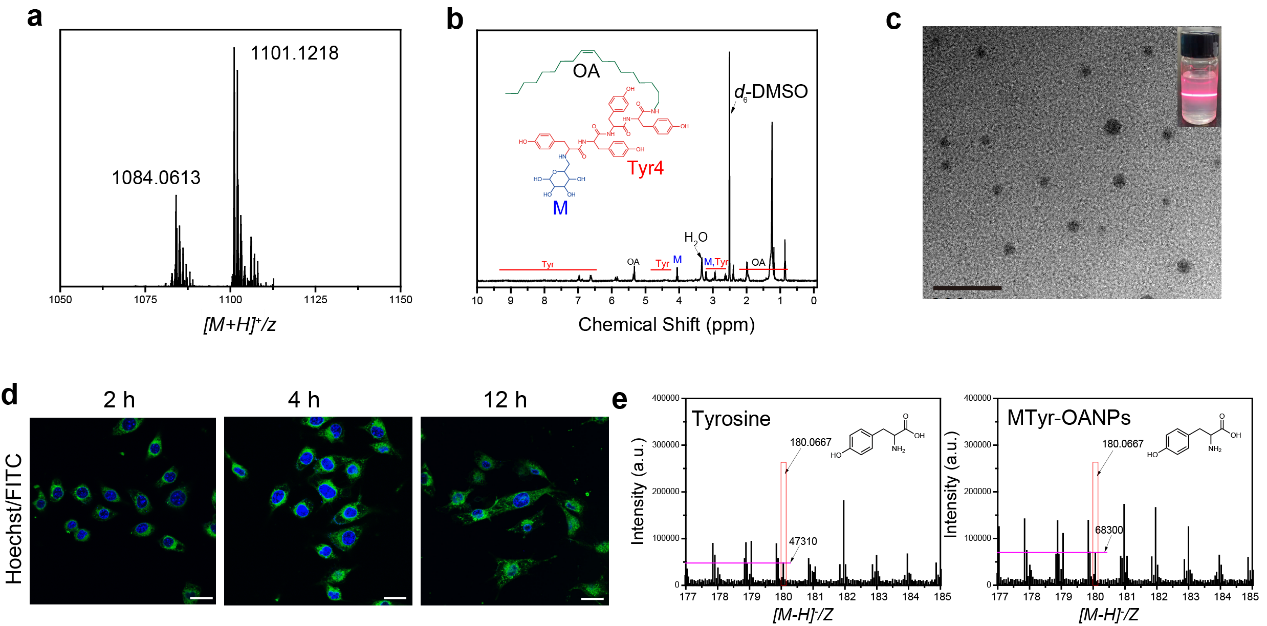
圖2. 酪氨酸納米膠束(MTyr-OANPs)的合成、表征及胞內遞送酪氨酸的效率
研究發現,酪氨酸納米膠束通過提高黑色素合成相關酶的活性及表達🚆、促進黑色素小體的合成等途徑🛌🏼,顯著激活了黑色素瘤細胞的黑素合成及分泌。與此同時⬜️,黑色素瘤細胞增殖也得到了顯著抑製。
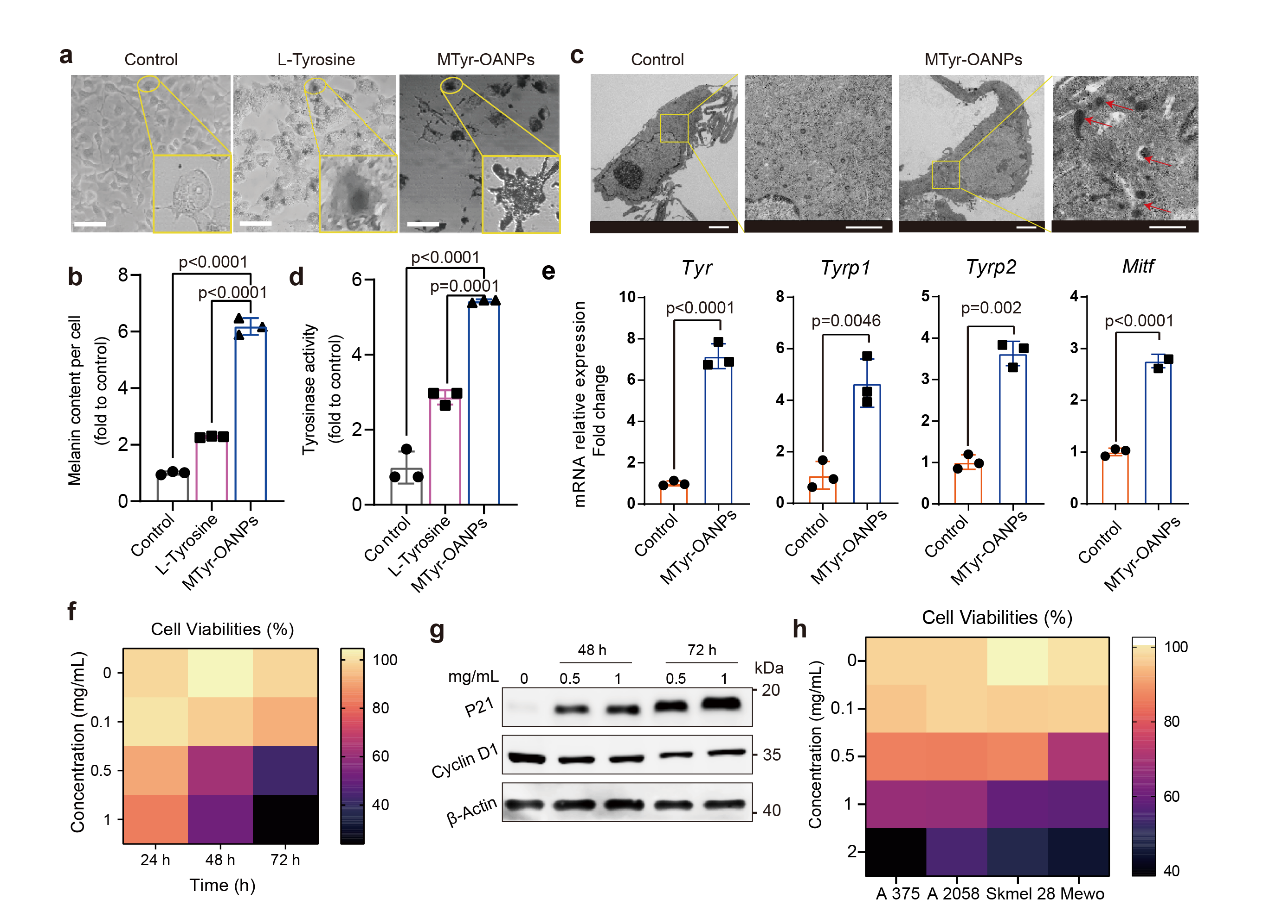
圖3. MTyr-OANPs 促進黑色素生成並抑製黑色素瘤細胞生長
在機製方面,團隊揭示出黑色素瘤的黑色素合成與糖酵解代謝之間存在相互作用📴。黑色素合成的中間代謝產物5,6-吲哚醌,可以抑製糖酵解關鍵酶-丙酮酸脫氫酶(PKM)的活性,從而幹擾癌細胞糖代謝抑製其增殖(圖4)🎾🧑🏻🏭。
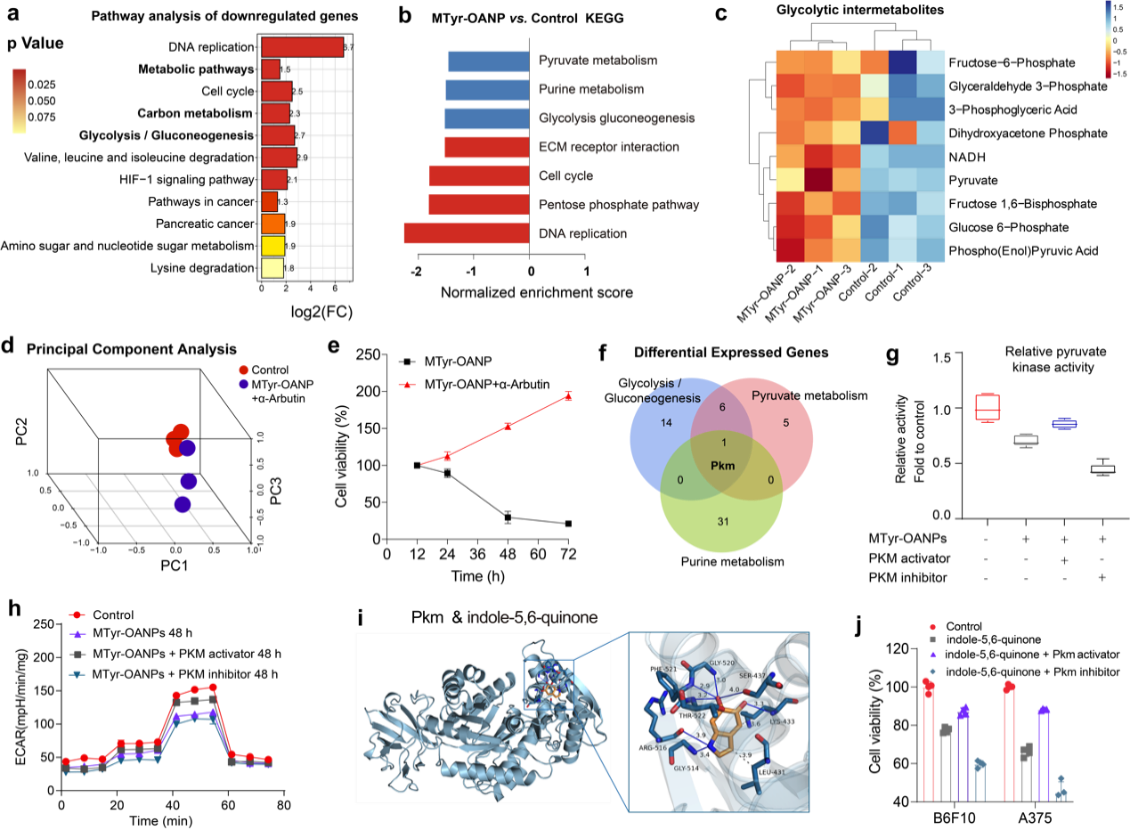
圖4. MTyr-OANPs激活黑色素合成與抑製黑色素瘤細胞增殖的機製分析
研究結果顯示,酪氨酸納米膠束在體內可靶向黑色素瘤(靶向效率4.4%),對小鼠和人來源的黑色素瘤(包括BRAF突變型/野生型)均發揮了較好的抗腫瘤效果,且對BRAF野生型腫瘤效果更好(圖5)🧗🏻♂️。研究指出😣,這可能與BRAF突變黑色素瘤中調控黑色素合成的轉錄因子MITF過度泛素化有關🧑🤝🧑,從而為該納米藥物的臨床應用提供了科學依據。
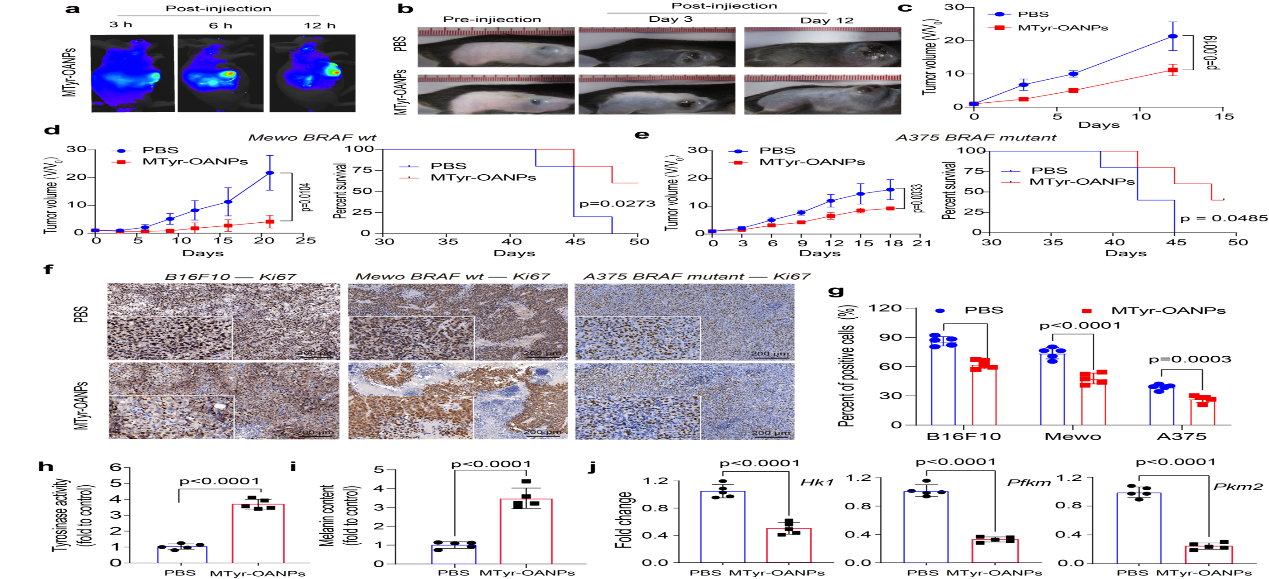
圖5. MTyr-OANPs 在小鼠體內的抗腫瘤活性
更令人驚喜的是,黑化的黑色素瘤細胞表現出對熱應激的抵抗下降🧑🏼🌾。而黑色素作為一種天然的光熱試劑,具有優異的光熱轉化性能。在酪氨酸納米膠束和近紅外光的共同作用下,小鼠黑色素瘤在治療第6天得到了根除,且在觀察的49天內無復發。這說明,重新激活腫瘤代謝通路後在腫瘤內部大量積累的代謝產物和表型重塑𓀑⏱,將有助於聯合已有臨床治療手段實現協同抗癌(圖6)。
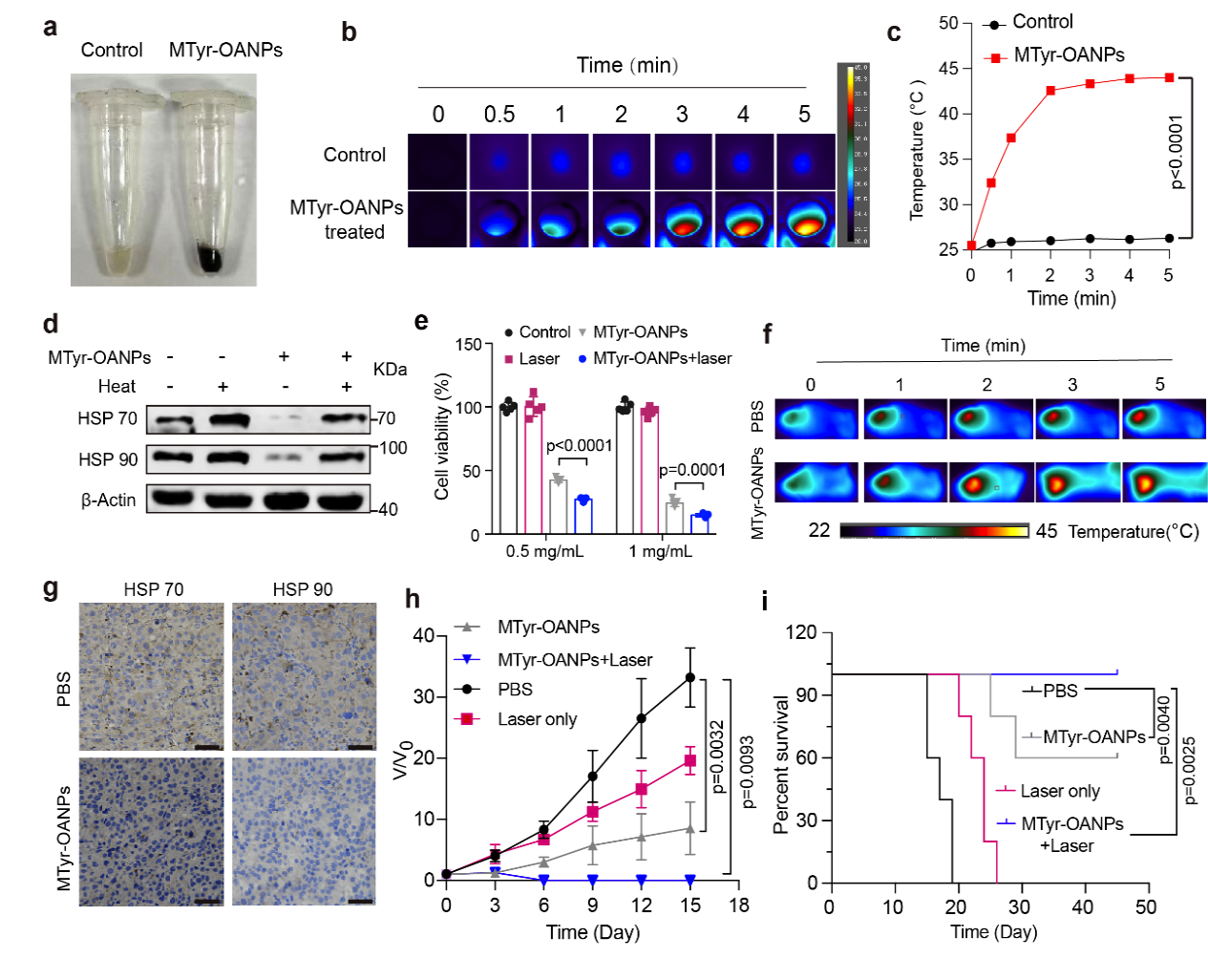
圖6. 表型重塑增強了黑色素瘤細胞對光熱治療的敏感性
據悉,該研究首次提出的基於營養物質納米化技術的“代謝重激活”新策略,為腫瘤治療開辟了新方向並提供了新技術方法,有望成為腫瘤代謝治療的新範式📓。通過揭示被抑製代謝通路與細胞及增殖之間的關系,可為腫瘤治療提供新的靶點🧛🏽♂️;更重要的是👆,代謝重激活後的腫瘤表型變化和代謝產物積累😹,可為聯合臨床已有治療手段提供新的契機。最後🧎♂️➡️,研究人員指出,他們正在著手其它類型難以根治的實體腫瘤,該療法的革新技術有望實現多種腫瘤的特異性代謝治療!
同濟大學附屬第十人民醫院與沐鸣2平台材料科學系聯合培養博士後🫸🏽、同濟大學生命科學與技術沐鸣2助理教授陳楊、同濟大學附屬第十人民醫院王超超副研究員和吳葉林研究員為該論文的共同第一作者;沐鸣2平台材料科學系/聚合物分子工程國家重點實驗室步文博教授、澳大利亞悉尼科技大學/寧波東方理工大學(籌)金大勇院士🫴🏻🏰、沐鸣2平台附屬華山醫院皮膚科吳金峰教授為論文共同通訊作者。該工作得到了國家自然科學基金👨🏻🍼、上海市教委創新重大基礎項目等經費支持。
論文鏈接🧖🏼🎽:https://doi.org/10.1038/s41565-024-01690-6





